
疫情三载已然消退,绿城重聚探讨认知。“第八次中国痴呆与认知障碍学术会议”于 4月1日在绿城郑州展开帷幕。本次会议线下参会逾千,学术内容涵盖了近年来痴呆与认知障碍领域的热点和难点。

专家简介:汤荟冬 教授
◆ 上海交通大学医学院附属瑞金医院神经内科主任医师,博士生导师
◆ 中华医学会神经病学分会认知障碍学组委员
◆ 中国医师协会神经内科分会认知障碍学组委员
◆ 中华医学会老年医学分会流行病学组委员
◆ 中国神经科学学会神经退行性疾病分会委员
◆ 中国老年医学会认知障碍分会常务委员
◆ 中华医学会肠外肠内营养学分会脑健康营养协作组副组长
◆ 长期从事神经变性疾病尤其是阿尔茨海默病临床流行病学及基础研究,在Alzheimer&Disease,Movement Disorder,Neurobiology of Aging,Aging&Disease,JAD,Sleep Medicine等杂志发表论文,主持和参与多项国家自然科学基金和科技部慢病相关课题。
❖
编者按:近几十年的临床经验表明,对于阿尔茨海默病(以下也称AD),针对单一靶点的治疗方案均未能产生较好的临床效果,因此,采取一种系统化、多靶点的策略来治疗AD,越来越受到该疾病领域专家们的重视。今天,我们来分享一篇根据上海交通大学医学院附属瑞金医院神经内科主任汤荟冬教授在 “第八次中国痴呆与认知障碍学术会议”上的发言,结合其演讲主旨的学术背景和相关研究数据所整理出来的文章,以阐述一种AD的可靠治疗策略。
越来越多研究表明:肠道菌群在AD病程中发挥了关键作用
阿尔茨海默病一直是一个难以被攻克的疾病领域,自该病被发现的120多年以来(1901年发现),其疾病成因至今未能够完全阐明。神经细胞外的淀粉样斑块以及细胞内的神经元纤维,被公认为是AD的主要病理标志物。长期以来,学界一直在探寻形成这两种物质的原因,提出了许多假设,包括淀粉样蛋白β(Aβ)、Tau蛋白、胆碱能神经元损伤和氧化应激、炎症等。

有鉴于AD病程的复杂性,AD的病理研究中越来越呈现出一种多元化的态势。2010年代以来,基于神经炎症和脑肠轴(肠道菌群)机制的AD病理理论愈发被学界重视,并被认为在AD进展的各个阶段中都发挥了较为重要的作用。
脑肠轴(或称“肠-脑轴”)作为连接大脑和肠消化道之间的桥梁,同时也连接了从上到下的神经和激素“网络”,包括下丘脑—垂体—肾上腺轴(HPA轴)、自主神经系统中的交感神经系统、副交感神经系统(迷走神经)及肠神经系统,以及肠道中的微生物群。
越来越多的证据表明,这个通道的作用是“双向性”的——即中枢神经系统可以经由该通道影响肠道菌群和外周神经系统,反之肠道微环境的紊乱也可以干扰中枢神经系统。
汤荟冬教授团队的研究发现,Aβ可以抑制脑肠轴中胆碱能抗炎的通路,引起肠道屏障的破坏和菌群的失调;反之,来自肠道的淀粉样蛋白也最终会引起大脑内淀粉样蛋白的沉积,进而促进AD的疾病进展 [1] [2]。
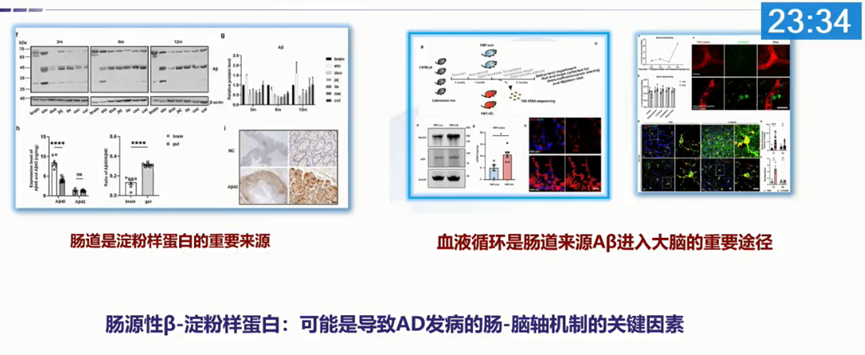
ApoE亚型和微生物群在神经变性进展中发挥重要作用
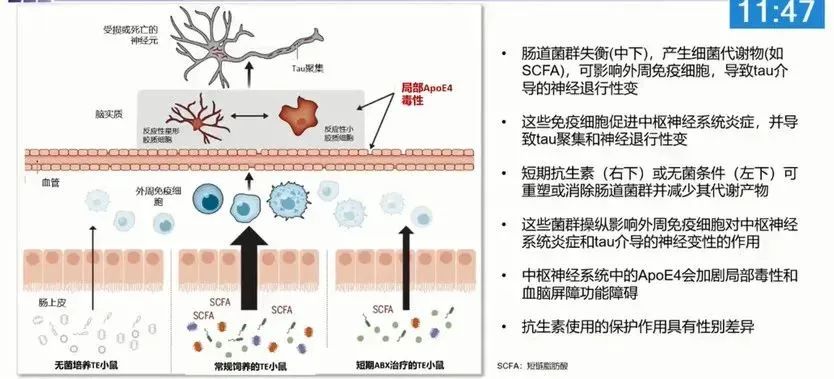
载脂蛋白E(ApoE)是一种与AD发病的关系最为密切的基因,携带其亚型ApoE e4基因的人患阿尔茨海默病的概率是正常人的2-3倍,现有证据表明,这类基因与肠道微生物一起在AD进展中扮演了关键角色。
2020年发表在《Frontiers in Immunology》上的一项研究发现,ApoE基因与肠道微生物的结构有着密切的相关性,可以影响到肠道菌群数量和种类的变化[3],鉴于ApeE基因广泛参与了各种AD相关病理的形成过程[4],所以肠道菌群(脑肠轴)也应与各种AD病理(如Tau蛋白和Aβ)存在着一定的关联性。
David Holtzman、Jeffery I. Gordon等人于今年1月在《Science》上发表的一篇论文进一步发现,通过短效抗生素或无菌环境改变肠道菌群及其代谢物的构成,可以使ApoE亚型相关的神经毒性和tau蛋白病变显著变少,这意味着靶向ApoE相关的肠道菌群或可以预防或治疗AD的发生以及疾病进展[5]。
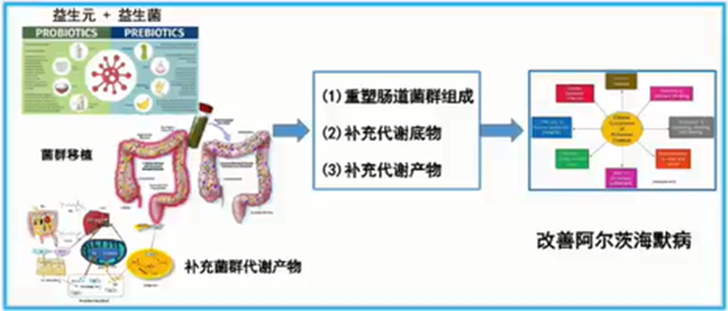
基于脑肠轴理论干预AD策略的临床研究现状
靶向脑肠轴的AD治疗策略,已经逐渐从理论走到了现实,常见的主要是三大类:
·第一类是直接补充益生菌、益生元、菌群代谢产物的相关疗法,也可以通过饮食改变来干预肠道菌群的构成,初步证实可以有效改善AD的相关病理和AD的症状。
·第二类是粪菌移植疗法(FMT),这一手段可以直接将患者的肠道环境改变;一些临床研究表明,当把正常的肠道菌群移植到AD小鼠的肠道中时,后者的疾病病理进展和AD症状可以得到明显的改善[6]。
·第三类是靶向修饰疗法,比如未来可能会推出的工程益生菌疗法或特异性细胞疗法,以及能够靶向修饰肠道微环境的药物甘露特钠胶囊(GV-971)[7]。
总之,脑肠轴理论和靶向修饰脑肠轴的疗法的出现,为AD的发病机制、早期的诊断和相关治疗靶点上提供了新的研究思路。但是,AD的发病机制仍存在很多未探明的领域,一些新颖治疗方法的的作用机制也未能完全揭露,而明确这些机制和相关靶点在其中的作用,就可以通过更多的医学手段来限制AD疾病的进展。


