
编者按
2018年7月17日,中国本土研制的抗阿尔茨海默病(AD)原创新药GV-971临床3期成功揭盲,在国内外引起了强烈反响。去年10月25日,在巴塞罗那举行的第11届国际阿尔茨海默病临床试验大会上,GV-971主要发明人、中科院上海药物研究所耿美玉研究员代表上海绿谷制药有限公司和全国34家从事GV-971临床3期试验的研究者做了主旨发言,首次在全球披露GV-971临床3期数据,现场反响强烈,获得了与会顶尖国际专家的高度认可。从GV-971的发现到临床3期试验成功完成,整个历程21年,这期间整个研发团队进行了艰苦卓越的工作。业界普遍关心的一个核心问题是,GV-971临床成功其作用机理是什么?9月6日,Cell Research上在线发表的耿美玉研究团队的研究论文揭示了GV-971的作用机理,对发现AD治疗新方案具有重大的意义。该研究成果还荣登Cell Research 10月刊封面。国际知名专家、美国神经学协会现任主席、华盛顿大学David M. Holtzman教授特别撰文highlight该文章。此外,熟悉相关工作的中国科学技术大学的朱书教授也应邀对该工作进行了点评,以飨读者!
撰文 | 任行星
9月6日,中国科学院上海药物研究所耿美玉课题组联合上海绿谷制药有限公司等研究团队在Cell Research杂志上发表了题为Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression的研究论文,研究发现在AD的进程中,肠道菌群失衡导致外周血中苯丙氨酸和异亮氨酸的异常增加,进而诱导外周促炎性Th1细胞的分化和增殖,并促进其脑内侵润。侵润入脑的Th1细胞和脑内固有的M1型小胶质细胞共同活化,导致AD相关神经炎症的发生。同步,该团队发现新型AD治疗药物GV-971通过重塑肠道菌群平衡、降低外周相关代谢产物苯丙氨酸/异亮氨酸的积累,减轻脑内神经炎症,进而改善认知障碍,达到治疗AD的效果。

Cell Research全文链接:
https://www.nature.com/articles/s41422-019-0216-x
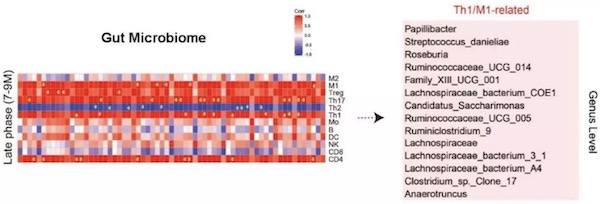
有研究提示肠道菌群参与触发大脑神经炎症【3】。因此,作者假设在AD进程中,以上菌群变化和神经炎症有密切关系,并加以确证。首先,利用IBA1染色和流式细胞分析发现,Tg小鼠脑内小胶质细胞(Microglia)在2-3月龄和7-9月龄呈现两种截然不同的激活状态。在2-3月龄时,促炎的M1型和神经保护的M2型小胶质细胞活化都在增加,随着疾病的进展,促炎的M1型小胶质细胞持续增加,并在7-9月龄时达到顶峰,然而神经保护的M2型小胶质细胞在3-5月龄开始下降,之后就维持在一个较低的水平。进一步分析AD进程中Tg小鼠脑中外周免疫细胞侵润状态,发现脑内外周侵润的CD45high细胞比例显著增高,并且CD4+ T细胞的两个主要亚型Th1和Th2表现出和促炎的M1型、神经保护的M2型小胶质细胞相似的变化过程。显然,该研究表明随着肠道菌群的失衡,脑内的神经炎症模式转为以Th1细胞和M1型小胶质细胞活化为主导。那么在AD的进程中,肠道菌群的丰度和大脑免疫细胞的变化是否有关联呢?作者分析发现在7-9月龄富集的肠道菌群与脑内Th1和M1细胞比例呈正相关(图1),这些结果表明,在AD的进程中,肠道菌群变化和脑内免疫细胞以及神经炎症密切相关。

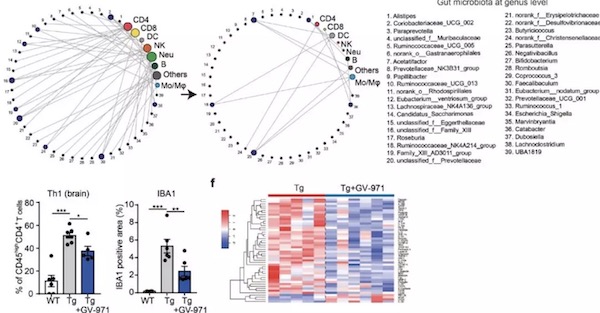
GV-971 处理一个月可明显降低Tg小鼠粪便和血液样本中苯丙氨酸和异亮氨酸的含量,并且减少苯丙氨酸或异亮氨酸所诱导的Th1细胞的分化,同步降低苯丙氨酸诱导的Th1细胞增殖。
为了进一步验证上述小鼠模型上的研究结果是否在临床样本上具有可重现性,作者又比较了轻度认知障碍AD患者和对应年龄段的健康人血液中苯丙氨酸、异亮氨酸和Th1免疫细胞等含量的差别,结果发现轻度认知障碍AD患者Phe/Ile水平和Th1细胞含量比例较健康人均明显升高,提示了该工作具有潜在的临床转化价值。
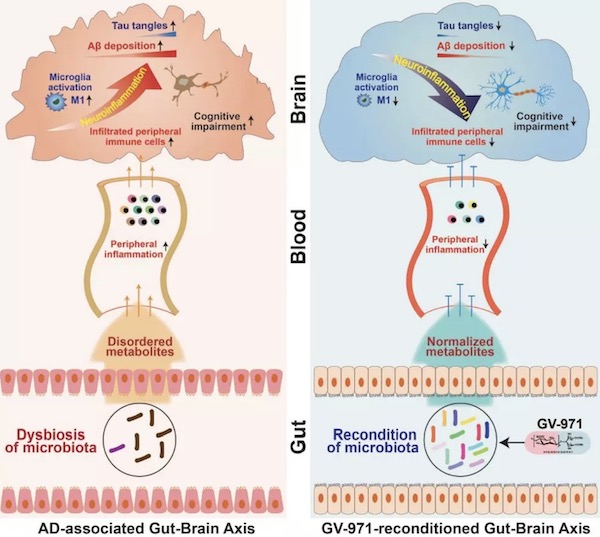
综上,在AD进程中,伴随Aβ的沉积以及Tau蛋白的磷酸化的发生,肠道菌群的组成发生变化,继而导致代谢产物异常,异常的代谢产物刺激外周免疫炎症,促使炎性免疫细胞Th1向大脑侵润,引起脑内M1型小胶质细胞的活化,导致AD相关神经炎症的发生,最终导致认知功能障碍。口服GV-971能够重塑肠道菌群,降低异常代谢产物,阻止外周炎性免疫细胞向大脑的侵润,抑制神经炎症,同时减少Aβ的沉积和Tau蛋白的磷酸化,从而改善认知障碍,达到治疗AD的目的(图4)。

国际著名专家美国神经学协会主席、华盛顿大学David M. Holtzman教授等特别撰文在Cell Research 同期发表题为“The microbiome: A target for Alzheimer disease?”的亮点评述,全文中文翻译如下:

David M. Holtzman教授是华盛顿大学圣路易斯医学院Hope Center神经系统疾病中心的科学主任,神经学系的教授及主任。是国际神经领域及AD研究领域的顶级科学家,现任美国神经学协会主席。主要学术贡献是发现了apoE与AD的关联性,揭示了突触功能及突触囊泡与突触释放Aβ的机制。开发了AD脑脊液的生物标志物,研制的靶向Aβ抗体和Tau蛋白抗体的药物分别在临床3期和2期进行研究。获得Paul Beeson Physician Faculty衰老研究学者奖、美国神经学会阿尔茨海默病Potamkin 奖、阿尔茨海默病MetLife奖、美国国家衰老研究所颁发的MERIT奖、创新及企业家Chancellor’s奖项数项。
Cell Research全文链接:https://www.nature.com/articles/s41422-019-0216-x
近年来,肠道微生物与疾病的研究无疑是生命科学领域最热门的话题之一,指数级增长的数据表明,“肠道-肠道微生物-大脑”双向调节系统不再仅仅是一个概念,这种双向作用模式组成了由上至下(top-down)和由下至上(down-top)的两种调节体系【6】(图a)。由上至下的调节,如中枢神经系统对消化系统的调节可通过影响肠动力、肠分泌、粘膜通透性等,而影响肠道微生物组分。脑肠互动异常引发的疾病如肠易激综合征(IBS)、胃肠道紊乱等的作用机制正逐步清晰【7】。而由下至上的调控,如肠道及肠道微生物调节大脑的功能及行为也越来越受到重视。目前,肠道菌群紊乱与一系列神经系统疾病包括自闭症、抑郁症、帕金森症、阿尔茨海默病等的关联也越来越清晰。因此,针对这些神经系统疾病,研究人员的目光已逐步从靶向中枢神经系统转移到靶向肠道微生物或者肠道免疫特征的研究上来【8】。
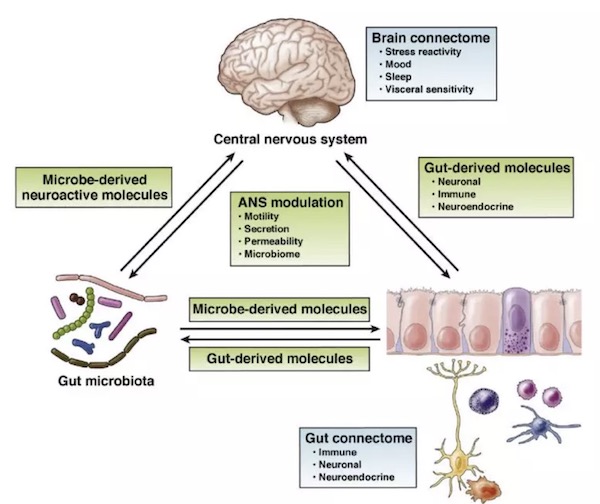
图a. 肠-肠道微生物-脑作用模式图【6】
肠道微生物对大脑的一个主要调节方式是通过神经免疫和神经内分泌系统实现。肠道微生物通过短链脂肪酸(Short-chain fatty acids,SCFAs)、次级胆汁酸(Secondary bile acids,2BAs)、色氨酸(Tryptophan)等代谢产物与肠道内分泌细胞(Enteroendocrine cells,EECs)、肠道嗜铬细胞(Enterochromaffin cells,ECCs)以及肠道粘膜免疫系统交互作用进而触发级联放大反应【9】。此外,肠道菌群也可以产生一些刺激神经组织的物质如γ-氨基丁酸(γ-aminobutyric acid)、5-羟色胺(5-HT)、去甲肾上腺素(Norepinephrine)、多巴胺(Dopamine)等通过直接或间接方式作用于大脑。尽管肠道与大脑的互作沟通方式多种多样,但是其因果关系特别是其精准的互作调控机制知之甚少【6】。
目前,有关肠道影响神经退行性疾病研究中,对帕金森症(Parkinson’s disease,PD)的研究最为深入,且近期取得了一系列突破性进展,为其它神经退行性疾病的研究提供了重要范例。2016年12月,加州理工学院科学家们在Cell发文,首次颠覆性证实肠道细菌和PD之间的功能联系,发现肠道菌群产生短链脂肪酸(SCFA)可以激活大脑小胶质细胞,进而引发神经炎症,致使神经元损伤【10】。今年6月26日,美国约翰霍普金斯大学研究人员在Neuron发文证实,错误折叠的α-突触核蛋白可以沿着迷走神经从小肠传播至大脑,通过切断迷走神经可阻止错误折叠α-突触核蛋白入脑,并提出阻断这种传播途径可能是预防帕金森病的关键所在,拓展PD干预新策略【11】。7月18日发表在Nature上的一项最新研究表明,肠道感染可以在人类疾病相关基因PINK1敲除的小鼠模型中,引发免疫反应,导致运动障碍及多巴胺能神经元丢失等帕金森病样病变,提示肠道感染可以作为PD的触发事件【12】(详见此前BioArt的相关报道:Nature亮点| 关键体内证据证实肠道感染与帕金森病关联)。
阿尔茨海默病(AD)作为一种典型的神经退行性疾病,尽管发现已有百余年的历史,但其发病机制仍然不十分清楚。截至目前,有关参与AD发生发展的假说多达30余种,包括大家熟知的Aβ沉积、神经纤维缠结、神经炎症、颅脑外伤等。近年随着生命科学的飞速发展,不断拓展业界对AD发病复杂机制的深度认知,2015年弗吉尼亚大学的神经学家Jonathan Kipnis团队在Nature上发文指出,大脑中“排污管”脑膜淋巴管障碍导致的脑实质中Aβ沉积是AD发病的重要原因【13】;2018年6月,西奈山医学院研究人员用大数据和无偏见(unbiased)系统研究体系,发现病原体参与AD的发生发展,证明人类疱疹病毒 6A (HHV-6A) 和 7 (HHV-7)与AD的关联最为密切【14】。而肠道菌群失衡与AD发生发展的关联性研究正在成为业界高度关注的热点话题,有研究发现AD患者肠道菌群失调引起促炎菌群增加,进而导致大脑炎症因子水平升高,引发神经退行性疾病【15】;实验动物则显示,AD小鼠肠道菌群的组成与健康小鼠不同,进一步研究发现无菌状态下的AD模型小鼠的大脑Aβ比AD模型小鼠显著减少,表明肠道菌群可影响Aβ沉积而影响AD病程进展【16】。
近日,中国科学院上海药物研究所耿美玉课题组联合上海绿谷制药有限公司科研团队在Cell Research杂志上发表了题为Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression的研究论文,进一步证实在AD发病过程中,肠道菌群紊乱自身足以引起脑内神经炎症,并首次发现菌群来源的氨基酸代谢产物的异常升高是菌群诱导神经炎症的一个重要机制,是导致AD认知障碍的关键。更重要的是,该团队首次揭示GV-971通过重塑肠道菌群平衡,降低肠道菌群代谢产物特别是苯丙氨酸和异亮氨酸的产生,降低外周及中枢炎症,减少脑内Aβ沉积和Tau过度磷酸化,从而改善认知功能障碍。
众所周知,AD患者的大脑促炎因子水平升高是一个普遍现象,有研究认为Aβ沉积导致炎性因子水平的升高;也有研究发现炎性因子升高是诱导Aβ沉积的原因【17】。有趣的是,Aβ具有一定的抗菌活性,研究发现AD病人的额叶匀浆能够抑制白色念珠菌的生长;在小鼠和线虫AD模型中,Aβ可以聚集成网络、阻止沙门氏菌或念珠菌感染,提示感染性的免疫反应可刺激Aβ产生【18】。基于AD患者肠道菌群具有其特殊组成,我们推测肠道中大量动态平衡的促炎和抑炎菌群在外界压力刺激条件下失去平衡、进而导致促炎反应发生,最终通过“脑-肠轴”促进神经炎症的发生(图b)。
耿美玉课题组的研究发现不但证实了上述这些疑问与猜想,而且首次提供了AD肠道菌群失调诱导大脑神经炎症的具体分子机制。她们发现肠道菌群失调导致包括苯丙氨酸和异亮氨酸在内的氨基酸的异常积累,这些异常氨基酸释放到外周血液,可促进Th1细胞等外周免疫细胞的分化和增殖,进而增加外周促炎型Th1等免疫细胞向大脑中的浸润,导致神经炎症的产生。上述研究成果为阐明AD复杂疾病的发病机制提供全新研究视角,为抗AD复杂疾病的药物研发提供全新干预策略。
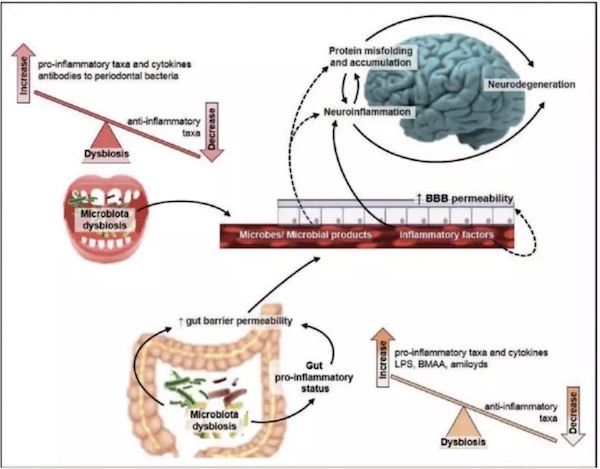
图b. 微生物在AD进程中可能的病理生理作用【19】
目前,AD药物开发主要聚焦于靶向大脑β淀粉样蛋白(Aβ)沉积和神经细胞Tau蛋白聚集。截至目前,全球累计研发投入超过6000亿美元,临床试验失败药物有320余个,失败率高达99.6%,17年无AD治疗新药上市。众所周知,2016年底制药巨头礼来公司备受瞩目的靶向Aβ治疗性抗体药物Solanezumab临床3期失败,使靶向Aβ的理论学说受到巨大冲击。2019年3月21日,百健及其合作伙伴日本卫材对两项靶向Aβ的抗体治疗药物Aducanumab(BIIB037)的3期临床试验的宣停,标志着单一靶向Aβ干预策略的局限【20】。有关Tau拮抗的多个药物处于临床的不同研究阶段,如TRx0237、RO7105705、C2N 8E12、BIIB092等,然而降低Tau蛋白能否有效治疗AD,以及降低其含量是否能导致其他的病理状态,目前尚存在巨大争议【19】,这些均极大地挑战了传统“一药一靶”的AD治疗策略。
耿美玉教授团队首次揭示GV-971是通过靶向脑-肠轴发挥其治疗AD的作用。系统研究发现GV-971通过重塑肠道菌群平衡,降低肠道菌群代谢产物特别是苯丙氨酸和异亮氨酸的产生,降低外周及中枢炎症,减少脑内Aβ沉积和Tau过度磷酸化,从而改善认知功能障碍。除了靶向调节肠道菌群失衡外,GV-971还能直接透过血脑屏障,通过多位点、多片段、多状态地捕获Aβ,抑制Aβ聚集体的形成,并使已形成的聚集体解聚。GV-971这种独特作用机制的阐明为该药3期临床试验的显著有效性与安全性提供了重要的科学依据。
耿美玉教授团队长期致力于抗老年痴呆药物的研发。该研究有望为AD的治疗带来“中国方案”,填补AD治疗领域内全世界17年没有新药上市的空白。尽管这一“中国方案”是否能为AD的治疗带来革命性的变化尚需药物上市后在更多患者群体获益后再予评价,但本研究的科研成果无疑大大增强了我们对AD治疗改善的信心,并且为拓辟AD治疗新路径提供了翔实的实验依据。
参考文献
1. Berchtold NC, Cotman CW. Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s. Neurobiol Aging 1998,19:173-189.
2. Mohajeri MH, La Fata G, Steinert RE, Weber P. Relationship between the gut microbiome and brain function. Nutrition Reviews 2018,76:481-496.
3. Sharon G, Sampson TR, Geschwind DH, Mazmanian SK. The Central Nervous System and the Gut Microbiome. Cell 2016,167:915-932.
4. Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity. Nature Reviews Immunology 2016,16:341-352.
5. Sinclair LV, Rolf J, Emslie E, Shi YB, Taylor PM, Cantrell DA. Control of amino-acid transport by antigen receptors coordinates the metabolic reprogramming essential for T cell differentiation. Nat Immunol 2013,14:500-508.
6. Martin CR, Osadchiy V, Kalani A, Mayer EA. The Brain-Gut-Microbiome Axis. Cell Mol Gastroenterol Hepatol 2018,6:133-148.
7. Bonaz BL, Bernstein CN. Brain-gut interactions in inflammatory bowel disease. Gastroenterology2013,144:36-49.
8. Fung TC, Olson CA, Hsiao EY. Interactions between the microbiota, immune and nervous systems in health and disease. Nature Neuroscience 2017,20:145-155.
9. Haghikia A, Jorg S, Duscha A, Berg J, Manzel A, Waschbisch A, et al. Dietary Fatty Acids Directly Impact Central Nervous System Autoimmunity via the Small Intestine. Immunity 2016,44:951-953.
10. Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, et al. Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson's Disease. Cell 2016,167:1469-1480 e1412.
11. Kim S, Kwon SH, Kam TI, Panicker N, Karuppagounder SS, Lee S, et al. Transneuronal Propagation of Pathologic alpha-Synuclein from the Gut to the Brain Models Parkinson's Disease. Neuron 2019.
12. Matheoud D, Cannon T, Voisin A, Penttinen AM, Ramet L, Fahmy AM, et al. Intestinal infection triggers Parkinson's disease-like symptoms in Pink1(-/-) mice. Nature 2019,571:565-569.
13. Da Mesquita S, Louveau A, Vaccari A, Smirnov I, Cornelison RC, Kingsmore KM, et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature 2018,560:185-191.
14. Readhead B, Haure-Mirande JV, Funk CC, Richards MA, Shannon P, Haroutunian V, et al. Multiscale Analysis of Independent Alzheimer's Cohorts Finds Disruption of Molecular, Genetic, and Clinical Networks by Human Herpesvirus. Neuron 2018,99:64-82 e67.
15. Mancuso C, Santangelo R. Alzheimer's disease and gut microbiota modifications: The long way between preclinical studies and clinical evidence. Pharmacological Research 2018,129:329-336.
16. Harach T, Marungruang N, Duthilleul N, Cheatham V, Mc Coy KD, Frisoni G, et al. Reduction of Abeta amyloid pathology in APPPS1 transgenic mice in the absence of gut microbiota. Sci Rep 2017,7:41802.
17. Heppner FL, Ransohoff RM, Becher B. Immune attack: the role of inflammation in Alzheimer disease.Nat Rev Neurosci 2015,16:358-372.
18. Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, et al. Amyloid-beta peptide protects against microbial infection in mouse and worm models of Alzheimer's disease. Sci Transl Med2016,8:340ra372.
19. Loera-Valencia R, Cedazo-Minguez A, Kenigsberg P, Page G, Duarte A, Giusti P, et al. Current and emerging avenues for Alzheimer's disease drug targets. J Intern Med 2019.
20. Panza F, Lozupone M, Seripa D, Imbimbo BP. Amyloid-beta immunotherapy for alzheimer disease: Is it now a long shot? Ann Neurol 2019,85:303-315.


